統合解析における有効性
ヴァイトラックビは一部承認外の効能又は効果、用法及び用量を含む臨床成績に基づいて評価され、承認されました。本統合解析の解析集団には承認外の効能又は効果、用法及び用量の患者が含まれますが、承認時評価資料のため紹介します。
統合解析における有効性
奏効率[主要評価項目、独立評価判定、検証的解析結果] / 病勢コントロール率[副次評価項目、独立評価判定]
- 独立評価判定による奏効率は72.6%(95%CI:65~79)(検証的解析結果)、CRが18.9%、病理学適CRが4.9%、PRが48.8%でした。
- 独立評価判定による病勢コントロール率は83.5%(95%CI:77~89)でした。

病変サイズの最大変化率のWaterfallプロット[独立評価判定]
- 病変サイズの最大変化率の中央値は-68%でした。
![奏効までの期間[副次評価項目、独立評価判定] 奏効までの期間[副次評価項目、独立評価判定]](/sites/g/files/vrxlpx16311/files/2021-08/pooled%20analysis_02.png)
癌腫別の奏効率[部分集団解析、独立評価判定]
- 10例以上が組み入れられた癌腫において、独立評価判定による奏効率は、軟部肉腫が77.8%(28/36例)、乳児線維肉腫が93.8%(30/32例)、甲状腺癌が55.6%(15/27例)、唾液腺癌が85.7%(18/21例)、非小細胞肺癌が76.9%(10/13例)でした。
![癌腫別の奏効率[部分集団解析、独立評価判定] 癌腫別の奏効率[部分集団解析、独立評価判定]](/sites/g/files/vrxlpx16311/files/2021-08/pooled%20analysis_03-02.png)
奏効までの期間[副次評価項目、独立評価判定]
- 奏効例119例において、奏効までの期間の中央値は1.84ヵ月(範囲:0.92~14.55、第1/第3四分位数:1.74/1.94)であり、2ヵ月以下が96例(80.7%)、2~4ヵ月が14例(11.8%)でした。
![奏効までの期間[副次評価項目、独立評価判定] 奏効までの期間[副次評価項目、独立評価判定]](/sites/g/files/vrxlpx16311/files/2021-08/pooled%20analysis_04.png)
奏効期間[副次評価項目、独立評価判定]
- 奏効例119例において、奏効期間の中央値は推定不能(95%CI:27.6~推定不能)であり、奏効持続率は12ヵ月時点で76%、24ヵ月時点で67%でした。
![奏効期間[副次評価項目、独立評価判定] 奏効期間[副次評価項目、独立評価判定]](/sites/g/files/vrxlpx16311/files/2021-08/pooled%20analysis_05.png)
治療期間のSwimmerプロット[治験責任医師判定]
- 治療期間のSwimmerプロットは以下のとおりでした。
![治療期間のSwimmerプロット[治験責任医師判定] 治療期間のSwimmerプロット[治験責任医師判定]](/sites/g/files/vrxlpx16311/files/2021-08/pooled%20analysis_06.png)
無増悪生存期間(PFS)[副次評価項目、独立評価判定]
- 独立評価判定によるPFSの中央値は33.4ヵ月(95%CI:19.3~推定不能)であり、無増悪生存率は12ヵ月時点で66%、24ヵ月時点で58%でした。
![無増悪生存期間(PFS)[副次評価項目、独立評価判定] 無増悪生存期間(PFS)[副次評価項目、独立評価判定]](/sites/g/files/vrxlpx16311/files/2021-08/pooled%20analysis_07.png)
全生存期間(OS)[副次評価項目]
- OSの中央値は推定不能(95%CI:44.4~推定不能)であり、全生存率は12ヵ月時点で90%、24ヵ月時点で82%でした。
![全生存期間(OS)[副次評価項目] 全生存期間(OS)[副次評価項目]](/sites/g/files/vrxlpx16311/files/2021-08/pooled%20analysis_08.png)
有効性の統合解析:解析概要
| 目的: | NTRK融合遺伝子陽性の進行・再発の固形癌患者を対象に、ヴァイトラックビの有効性を評価する。 |
| 対象: | 試験20288、NAVIGATE試験、SCOUT試験(試験デザインについてはこちら)に組み入れられ、ヴァイトラックビを1回以上投与された中枢神経系原発腫瘍以外の腫瘍かつ測定可能病変を有するNTRK融合遺伝子陽性患者164例(ePAS4) |
| 評価項目: | [主要評価項目] RECIST Ver.1.1に基づく独立評価判定による奏効率(検証的解析項目) [副次評価項目] RECIST Ver.1.1に基づく治験責任医師判定による奏効率、独立評価判定および治験責任医師判定による奏効までの期間、奏効期間、病勢コントロール率、無増悪生存期間(PFS)、全生存期間(OS)など |
| 判定基準: | 画像検査はスクリーニング時、サイクル2~12までの奇数サイクル第1日目(±7日)(もしくは偶数サイクル終了時)およびサイクル13以降は3サイクルごとの第1日目(±7日)に実施した。腫瘍縮小効果は最初の奏効から28日以降に行われた画像検査により確定した。 |
| 解析計画: | 事前に規定した中間解析の結果に基づき、無効中止、有効中止、安全性中止を評価することとした。 NTRK融合遺伝子陽性の固形癌に対するヴァイトラックビの奏効率を50%以上と仮定し、検出力を80%とした場合、奏効率の推定値の二項分布に基づく正確な両側95%CIの下限値が30%を超えるためには、55例の被験者が必要と推定された。 奏効率:点推定値とClopper-Pearson法を用いて正確な両側95%CIを算出した。 奏効までの期間:Kaplan-Meier曲線を用いて経時的に提示した(奏効例のみで算出)。 奏効期間、PFS、OS:Greenwoodの公式を用いて算出した中央値の両側95%CIとともに、Kaplan-Meier法を用いて記述的に要約した。 病勢コントロール率:確定したCRまたはPR、あるいは16週以上持続するSDが認められた患者の割合(解析方法は奏効率と同様)とした。 サブグループ解析:性別、年齢範囲、人種、癌腫、ベースラインの疾患特性、NTRK融合遺伝子別および分子種別の解析は事前に規定された。 |
有効性の統合解析:患者背景
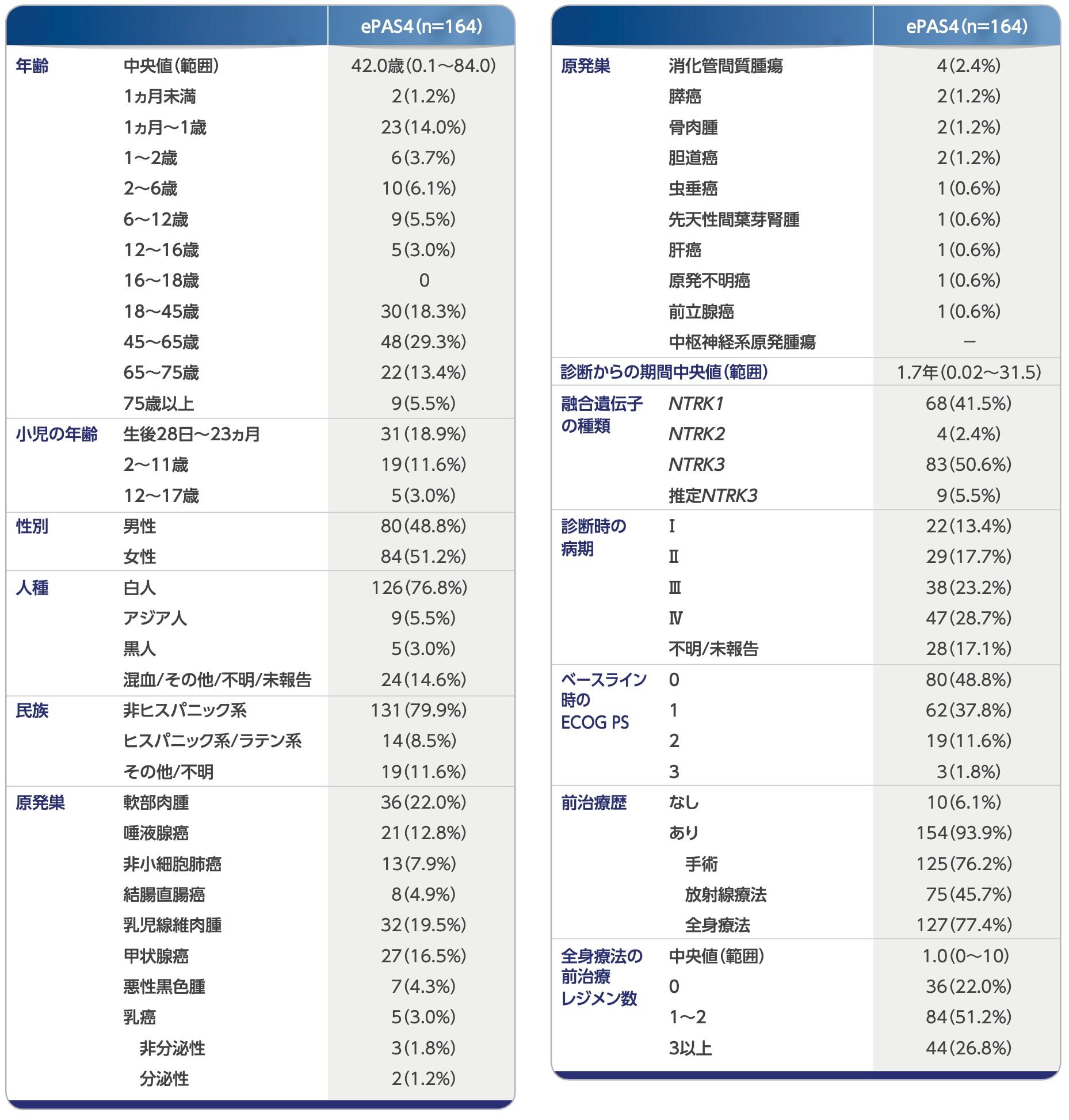
本統合解析の安全性解析集団には、NTRK融合遺伝子非陽性および承認用量よりも低用量または高用量が使用された患者が含まれます。
4. 効能又は効果
NTRK融合遺伝子陽性の進行・再発の固形癌
6. 用法及び用量
通常、成人にはラロトレクチニブとして1回100mgを1日2回経口投与する。なお、患者の状態により適宜減量する。
通常、小児にはラロトレクチニブとして1回100mg/m2(体表面積)を1日2回経口投与する。ただし、1回100mg を超えないこと。
なお、患者の状態により適宜減量する。
バイエル薬品社内資料[統合解析](承認時評価資料)


